中山一院謝曉燕教授團隊與中山大學帥心濤教授團隊在國際知名雜志Nano Today發(fā)表納米材料腫瘤免疫治療研究成果
?????? 2月18日,中山大學附屬第一醫(yī)院超聲醫(yī)學科謝曉燕教授團隊與中山大學材料科學與工程學院帥心濤教授團隊的交叉學科合作研究成果在高質量雜志Nano Today上以research article的形式發(fā)表,論文題目為Nanodrug shows spatiotemporally controlled release of anti-PD-L1 antibody and STING agonist to effectively inhibit tumor progression after radiofrequency ablation,。該研究受到國家自然科學基金重大研究計劃項目,、國家自然科學基金面上項目、國家自然科學基金青年項目及廣州市重點領域研發(fā)計劃項目等資助,。中山一院為論文第一單位及通訊單位,,謝曉燕教授、帥心濤教授,、徐明副教授及張春陽副研究員為共同通訊作者,,中山一院博士后郭煥玲、中山大學附屬第七醫(yī)院助理研究員黃金生及中山一院助理研究員譚洋為共同第一作者,。
?

?
??????? 射頻消融(Radiofrequency ablation, RFA)因其微創(chuàng),、療效確切、住院時間短等優(yōu)勢,,已發(fā)展為腫瘤綜合治療的重要組成部分,,廣泛應用于原發(fā)或者轉移性肝臟腫瘤等實體腫瘤的治療。但是,,對于腫瘤直徑大于3 cm、形態(tài)不規(guī)則,、位于重要臟器及大血管旁的腫瘤,,RFA往往難以達到完全消融,是導致腫瘤復發(fā)進展的重要原因,。與外科手術切除不同的是,,RFA是通過熱效應使腫瘤發(fā)生原位凝固性壞死,在這個過程中,,可促發(fā)大量腫瘤相關抗原釋放,,誘導機體產生抗腫瘤免疫效應。然而,,謝曉燕教授團隊在多年腫瘤消融的臨床實踐及相關研究中發(fā)現(xiàn),,腫瘤消融術后所產生的抗腫瘤免疫效應不足以抑制殘余腫瘤復發(fā),且部分患者出現(xiàn)腫瘤惡化進展,,目前相關機制尚未明確,。
?????? 近年來,程序性死亡受體-1/程序性死亡配體-1(Programmed cell death protein-1/Programmed cell death ligand 1, PD-1/PD-L1)拮抗治療在腫瘤免疫治療領域取得了重大突破,。謝曉燕教授團隊在不完全消融腫瘤動物模型中發(fā)現(xiàn),,消融術后殘余腫瘤表面PD-L1顯著上調,這表明PD-1/PD-L1參與消融術后殘余腫瘤發(fā)生免疫逃逸,。然而,,回顧性研究和動物實驗數(shù)據(jù)均表明,單一PD-1/PD-L1拮抗治療對RFA術后腫瘤進展療效欠佳。研究團隊進一步分析發(fā)現(xiàn),,RFA術后殘余腫瘤STING通路激活不足,,導致殘余腫瘤中T淋巴細胞浸潤少,是PD-1/PD-L1拮抗治療不佳的可能原因,。
?????? 但是,,目前STING通路激活劑和PD-1/PD-L1拮抗抗體聯(lián)合治療仍存在難題:PD-1/PD-L1拮抗抗體和STING通路激活藥物的臨床應用仍受限于因藥物非靶向輸送導致的免疫相關毒副作用。此外,,PD-L1抗體及STING激活劑的作用位點分別位于腫瘤細胞表面及抗原提呈細胞內,,需要達到亞細胞層面精準遞送才可實現(xiàn)藥物的有效協(xié)同作用。
?????? 為解決這一難題,,該研究采用帥心濤教授團隊研發(fā)的生物相容性的磷脂材料及其團隊制備的一種pH和MMP-2雙重敏感的納米囊泡,,實現(xiàn)了亞細胞水平的程序性精準藥物控釋。納米囊泡的水腔包裹STING激活劑,,表層通過MMP-2敏感的短肽PLGVRG偶聯(lián)抗PD-L1抗體,。同時,通過酸敏感的酰胺鍵偶聯(lián)PEG,,可阻礙抗PD-L1抗體與PD-L1陽性的正常組織結合,,從而賦予了納米藥物的隱身性能。當納米藥物富集在腫瘤組織中后,,PEG殼層和抗體分別在殘余腫瘤微環(huán)境的酸性條件和MMP-2的觸發(fā)下依次釋放,。而PEG和抗體的釋放使得囊泡的表面電位從負電性翻轉為正電性,促進了載STING激活劑囊泡被抗原提呈細胞內吞,,使得STING激活劑在胞質有效激活STING通路,。體外和荷瘤小鼠的實驗數(shù)據(jù)均表明,該體系可通過激活樹突狀細胞,,增加抗腫瘤T淋巴細胞的瘤內浸潤,,從而顯著抑制RFA術后殘余腫瘤的進展。此外,,與非PEG屏蔽的納米藥物組相比,,PEG屏蔽層顯著降低了STING激活劑和抗PD-L1抗體治療導致的肝臟毒性。
?????? 該研究為以PD-1/PD-L1為靶點的RFA后腫瘤綜合治療提供了理論依據(jù),,為受困于免疫藥物耐藥和毒副作用的腫瘤患者帶來了新的希望,,對改善腫瘤RFA術后預后具有潛在的臨床價值。
?
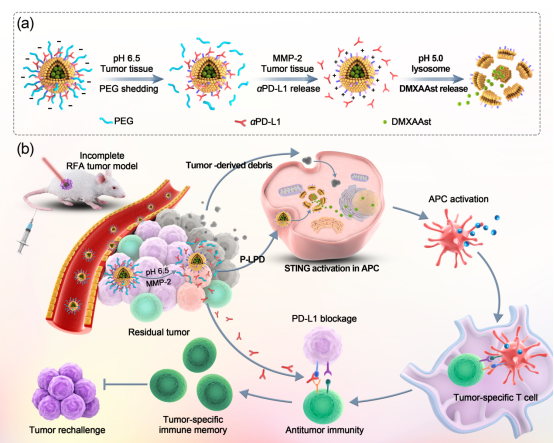
MMP-2/pH雙敏感脂質體共載STING激活劑和抗PD-L1抗體協(xié)同激活射頻消融術后抗腫瘤免疫,,抑制殘余腫瘤進展和復發(fā)
?
?????? 論文鏈接:https://www.sciencedirect.com/science/article/pii/S1748013222000524
?
?
(來源:超聲醫(yī)學科)
?





